Nepodávajú úplné informácie o zložení v*kcín
Milá Wahlgrenis,
dnes som úplnou náhodou zistila, že nám nepodávajú úplné informácie o zložení v*kcín.
Obsahujú totiž polyethylene glycol (PEG).
Je súčasťou ALC-0159, ktorému sa už vyhýbajú aj kozmetické spoločnosti kôli možným alergickým reakciám.
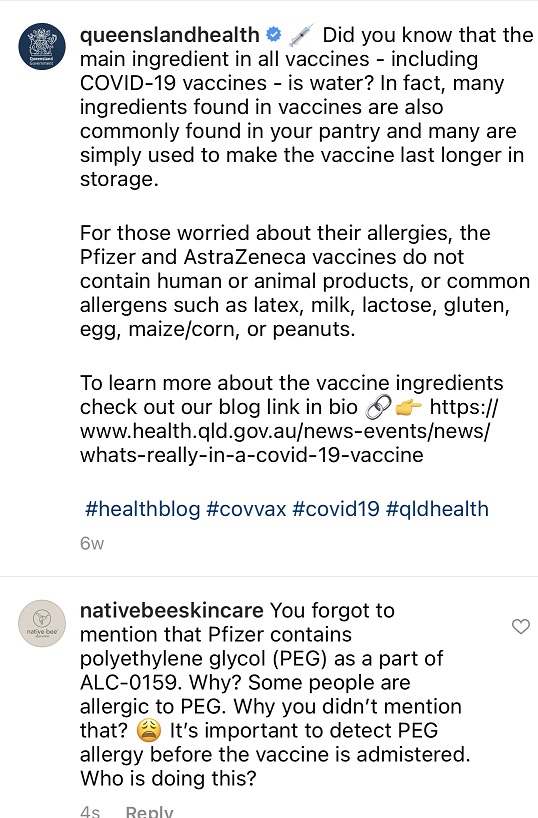
Boli prípady, kedy v*kcínu podali ľuďom alergickým na PEG.
Nikto to pred podaním neskúma.
Nikoho to nezaujíma.
Ten, kto zvažuje o*kovanie, mal by sa dať testovať na alergiu na PEG pred tým, než sa dá o*kovať.
Nepáči sa mi tento prístup.
Je to nekalé.
Nám to tu prezentujú, ako keby v*kcína obsahovala len vodu.
Tak ale toto ma neskutočne naštvalo.
Je to hnus.
Je to neetické.
Zdraví,
Česima 23.10.2021
PŘÍLOHA I
SOUHRN ÚDAJŮ O PŘÍPRAVKU
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky.
Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1. NÁZEV PŘÍPRAVKU Comirnaty 500 mikrogramů/ml koncentrát pro injekční disperzi mRNA vakcína proti onemocnění COVID-19 (modifikovaný nukleosid)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedná se o vícedávkovou injekční lahvičku, jejíž obsah je nutno před použitím naředit.
Jedna injekční lahvička (0,45 ml) obsahuje 6 dávek po 0,3 ml po naředění, viz body 4.2 a 6.6.
1 dávka (0,3 ml) obsahuje 30 mikrogramů mRNA vakcíny proti onemocnění COVID-19 (zapouzdřené v lipidových nanočásticích).
Jednovláknová mediátorová (messenger) RNA (mRNA) s čepičkou na 5´ konci vyráběná in vitro nebuněčnou transkripcí z příslušných matricí DNA a kódující spike (S) protein viru SARS-CoV-2.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA Koncentrát pro injekční disperzi (sterilní koncentrát).
Vakcína je bílá až téměř bílá zmrazená disperze (pH: 6,9–7,9).
4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Vakcína Comirnaty je indikována pro aktivní imunizaci k prevenci onemocnění COVID-19
způsobeného virem SARS-CoV-2 u osob ve věku 12 let a starších.
Tuto vakcínu je třeba používat v souladu s oficiálními doporučeními.
4.2 Dávkování a způsob podání Dávkování
Osoby ve věku 12 let a starší
Vakcína Comirnaty se podává intramuskulárně po naředění jako primární cyklus 2 dávek (0,3 ml každá dávka). Druhou dávku se doporučuje podat 3 týdny po první dávce (viz body 4.4 a 5.1).
Posilovací dávka (třetí dávka) vakcíny Comirnaty může být podána intramuskulárně minimálně 6 měsíců po druhé dávce u jedinců ve věku 18 let a starších. Rozhodnutí, kdy a komu podat třetí dávku vakcíny Comirnaty, má být učiněno na základě dostupných údajů o účinnosti vakcíny, s přihlédnutím k omezeným údajům o bezpečnosti (viz body 4.4 a 5.1).
Nebylo stanoveno, zda lze za účelem dokončení primárního vakcinačního cyklu nebo posilovací dávky (třetí dávka) zaměnit vakcínu Comirnaty za jinou vakcínu proti onemocnění COVID-19.
Osobám, jimž byla podána 1 dávka vakcíny Comirnaty, má být podána i druhá dávka této vakcíny, aby byl primární vakcinační cyklus a jakékoli další dávky dokončeny.
Těžce imunokompromitované osoby ve věku 12 let a starší
Třetí dávka může být podána nejméně 28 dní po druhé dávce jedincům s těžkou poruchou imunity (viz bod 4.4).
Pediatrická populace
Bezpečnost a účinnost vakcíny Comirnaty u pediatrických účastníků ve věku do 12 let nebyly dosud stanoveny. K dispozici jsou omezené údaje.
Starší populace
U osob ve věku ≥ 65 let není nutná žádná úprava dávkování. Bezpečnost a imunogenicita posilovací dávky (třetí dávky) vakcíny Comirnaty u osob ve věku 65 let a starších je založena na údajích o bezpečnosti a imunogenicitě u dospělých ve věku 18 až 55 let.
Způsob podání
Vakcína Comirnaty se podává intramuskulárně po naředění (viz bod 6.6).
Po naředění obsahují injekční lahvičky vakcíny Comirnaty šest dávek po 0,3 ml vakcíny. K získání šesti dávek z jedné injekční lahvičky je třeba použít injekční stříkačky a/nebo jehly s malým mrtvým prostorem. Kombinace injekční stříkačky a jehly s malým mrtvým prostorem má mít mrtvý objem maximálně 35 mikrolitrů. Pokud se používají standardní injekční stříkačky a jehly, nemusí být dostatečný objem k získání šesté dávky z jedné injekční lahvičky. Bez ohledu na typ injekční stříkačky a jehly:
• Každá dávka musí obsahovat 0,3 ml vakcíny.
• Pokud množství vakcíny zbývající v injekční lahvičce nemůže poskytnout plnou dávku 0,3 ml, injekční lahvičku a veškerý přebytečný objem zlikvidujte.
• Nekombinujte obsah z více injekčních lahviček vakcíny.
Preferované místo je deltový sval horní části paže.
Vakcína se nesmí podávat intravaskulárně, subkutánně ani intradermálně.
Vakcína se nesmí mísit ve stejné injekční stříkačce s jinými vakcínami nebo léčivými přípravky.
Pro opatření před podáním vakcíny viz bod 4.4.
Návod pro rozmrazení, zacházení s vakcínou a její likvidaci je uveden v bodě 6.6.
4.3 Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití Sledovatelnost
Aby se zlepšila sledovatelnost biologických léčivých přípravků, má se přehledně zaznamenat název podaného přípravku a číslo šarže.
Obecná doporučení
Hypersenzitivita a anafylaxe
Byly hlášeny případy anafylaxe. Pro případ, že by po podání vakcíny došlo k anafylaktické reakci, má být zajištěna okamžitá lékařská péče a dohled.
Po vakcinaci se doporučuje pečlivé sledování po dobu minimálně 15 minut. Druhá dávka vakcíny nemá být podána osobám, které měly anafylaxi na první dávku vakcíny Comirnaty.
Myokarditida a perikarditida
Po očkování vakcínou Comirnaty byly pozorovány velmi vzácné případy myokarditidy a
perikarditidy. K těmto případům došlo zejména do 14 dnů po očkování, častěji po druhé dávce vakcíny a častěji u mladších mužů. Dostupné údaje naznačují, že průběh myokarditidy a perikarditidy po vakcinaci se neliší od myokarditidy nebo perikarditidy obecně.
Zdravotničtí pracovníci mají pozorně sledovat známky a příznaky myokarditidy a perikarditidy.
Očkovaní jedinci mají být poučeni, aby okamžitě vyhledali lékařskou pomoc, pokud se u nich po očkování objeví příznaky naznačující myokarditidu nebo perikarditidu, například bolest na hrudi (akutní a přetrvávající), dušnost nebo palpitace.
Zdravotničtí pracovníci mají k diagnostice a léčbě tohoto onemocnění používat návody a postupy a/nebo se mají obrátit na specialisty.
Riziko myokarditidy po třetí dávce vakcíny Comirnaty nebylo dosud popsáno.
Reakce spojené s úzkostí
V souvislosti se samotným procesem očkování se mohou objevit reakce spojené s úzkostí, včetně vazovagálních reakcí (synkopa), hyperventilace nebo reakcí spojených se stresem (např. závrať, palpitace, zvýšení srdeční frekvence, změny krevního tlaku, pocit brnění a pocení). Reakce spojené se stresem jsou dočasné a samy se upraví. Očkované osoby je třeba informovat o tom, aby na případné symptomy upozornily očkujícího zdravotníka, který je vyhodnotí. Je důležité, aby byla zavedena opatření, aby se zabránilo zranění v důsledku mdlob.
Současné onemocnění
U osob trpících závažným akutním horečnatým onemocněním nebo akutní infekcí se má podání vakcíny Comirnaty odložit. Přítomnost mírné infekce a/nebo horečky nízkého stupně není důvod k odložení vakcinace.
Trombocytopenie a poruchy koagulace
Stejně jako u jiných intramuskulárních injekcí je třeba vakcínu podávat opatrně osobám podstupujícím léčbu antikoagulancii nebo osobám s trombocytopenií nebo poruchami koagulace (jako je hemofilie), protože po intramuskulárním podání může u těchto osob dojít ke krvácení nebo tvorbě modřin.
Imunokompromitované osoby
Účinnost a bezpečnost vakcíny nebyly hodnoceny u imunokompromitovaných osob, včetně osob podstupujících imunosupresivní léčbu. Účinnost vakcíny Comirnaty může být u
imunokompromitovaných osob nižší. Doporučení zvážit podání třetí dávky u těžce imunokompromitovaných jedinců je založeno na omezených sérologických důkazech z případových studií z literatury z klinické léčby pacientů s iatrogenní imunosupresí po transplantaci solidních orgánů (viz bod 4.2).
Doba ochrany
Doba ochrany poskytovaná vakcínou není známa, protože je stále hodnocena v probíhajících klinických studiích.
Omezení účinnosti vakcíny
Podobně jako u jiných vakcín je možné, že vakcinace vakcínou Comirnaty nebude chránit všechny její příjemce. Osoby nemusí být plně chráněny po dobu 7 dnů po druhé dávce vakcíny.
Pomocné látky
Tato vakcína obsahuje méně než 1 mmol (39 mg) draslíku v jedné dávce, to znamená, že je v podstatě „bez draslíku“.
Tato vakcína obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, to znamená, že je v podstatě „bez sodíku“.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Nebyly provedeny žádné studie interakcí.
Současné podání vakcíny Comirnaty s jinými vakcínami nebylo hodnoceno.
4.6 Fertilita, těhotenství a kojení Těhotenství
Údaje o podávání vakcíny Comirnaty těhotným ženám jsou omezené. Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na těhotenství, vývoj embrya/plodu, porod nebo postnatální vývoj (viz bod 5.3). Podávání vakcíny Comirnaty v těhotenství se má zvážit pouze v případě, pokud možné přínosy převáží jakákoli potenciální rizika pro matku a plod.
Kojení
Není známo, zda se vakcína Comirnaty vylučuje do lidského mateřského mléka.
Fertilita
Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky s ohledem na reprodukční toxicitu (viz bod 5.3)
4.7 Účinky na schopnost řídit a obsluhovat stroje Vakcína Comirnaty nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
Některé z účinků uvedených v bodě 4.8 však mohou schopnost řídit nebo obsluhovat stroje dočasně ovlivnit.
4.8 Nežádoucí účinky Souhrn bezpečnostního profilu
Bezpečnost vakcíny Comirnaty byla hodnocena ve 2 klinických studiích u účastníků ve věku 12 let a starších, které zahrnovaly 23 205 účastníků (22 074 účastníků ve věku 16 let a starších a 1 131 dospívajících ve věku 12 až 15 let), kteří dostali alespoň jednu dávku vakcíny Comirnaty.
Celkový bezpečnostní profil vakcíny Comirnaty u dospívajících ve věku 12 až 15 let byl podobný, jako u účastníků ve věku 16 let a starších.
306 stávajících účastníků fáze 3 ve věku 18 až 55 let dostalo dále posilovací dávku (třetí dávku) vakcíny Comirnaty přibližně 6 měsíců po druhé dávce. Celkový bezpečnostní profil posilovací dávky (třetí dávky) byl podobný jako po 2 dávkách.
Účastníci ve věku 16 let a starší – po 2 dávkách
Ve studii 2 byla celkem 22 026 účastníkům ve věku 16 let nebo starším podána alespoň 1 dávka vakcíny Comirnaty a celkem 22 021 účastníkům ve věku 16 let nebo starším bylo podáno placebo (včetně 138 a 145 dospívajících ve věku 16 a 17 let ve skupinách vakcíny a placeba, v uvedeném pořadí). Celkem 20 519 účastníků ve věku 16 let nebo starších dostalo 2 dávky vakcíny Comirnaty.
V době provedení analýzy studie 2 s datem ukončení sběru dat 13. března 2021 pro placebem kontrolované zaslepené období sledování až do dat odlepení účastníků bylo celkem 25 651 (58,2 %) účastníků (13 031 Comirnaty a 12 620 placebo) ve věku 16 let a starších sledováno po dobu ≥4 měsíce po podání druhé dávky. To zahrnovalo celkem 15 111 (7 704 Comirnaty a 7 407 placebo) účastníků ve věku 16 až 55 let a celkem 10 540 (5 327 Comirnaty a 5 213 placebo) účastníků ve věku 56 let a
starších.
Nejčastějšími nežádoucími účinky byla u účastníků ve věku 16 let a starších, kteří dostali 2 dávky, bolest v místě injekce (> 80 %), únava (> 60 %), bolest hlavy (> 50 %), myalgie (> 40 %), zimnice (> 30 %), artralgie (> 20 %), pyrexie a zduření v místě injekce (> 10 %). Tyto nežádoucí účinky byly zpravidla mírné nebo střední intenzity a odezněly během několika dní po vakcinaci. Mírně nižší frekvence příhod reaktogenity souvisela s vyšším věkem.
Bezpečnostní profil u 545 účastníků ve věku 16 let a starších, kterým byla podána vakcína Comirnaty a kteří byli séropozitivní na SARS-CoV-2 při výchozím stavu, byl podobný jako u obecné populace.
Dospívající ve věku 12 až 15 let – po 2 dávkách
V analýze studie 2 na základě údajů získaných do data ukončení sběru dat 13. března 2021 bylo 2 260 dospívajících (1 131 dostalo vakcínu Comirnaty a 1 129 dostalo placebo) ve věku 12 až 15 let. Z toho 1 308 dospívajících (660 dostalo vakcínu Comirnaty a 648 dostalo placebo) bylo sledováno po dobu nejméně 2 měsíců po druhé dávce vakcíny Comirnaty. Hodnocení bezpečnosti ve studii 2 probíhá.
Nejčastějšími nežádoucími účinky u dospívajících ve věku 12 až 15 let, kteří dostali 2 dávky, byly bolest v místě vpichu (> 90 %), únava a bolest hlavy (> 70 %), myalgie a zimnice (> 40 %), artralgie a pyrexie (> 20 %).
Účastníci ve věku 18 let a starší - po posilovací dávce (třetí dávka)
Podskupina účastníků studie fáze 2/3, do které bylo zařazeno 306 dospělých ve věku 18 až 55 let, kteří dokončili původní cyklus 2 dávek vakcíny Comirnaty 2, dostala posilovací dávku (třetí dávku) vakcíny Comirnaty přibližně 6 měsíců (rozmezí 4,8 až 8,0 měsíců) po podání 2. dávky.
Nejčastějšími nežádoucími účinky u účastníků ve věku 18 až 55 let byly bolest v místě vpichu (>80 %), únava (> 60 %), bolest hlavy (> 40 %), myalgie (> 30 %), zimnice a artralgie (> 20 %).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V a uvedli přitom číslo šarže, je-li k dispozici.
4.9 Předávkování Údaje o předávkování jsou k dispozici od 52 účastníků studie zařazených do klinického hodnocení, kterým bylo kvůli chybě v ředění podáno 58 mikrogramů vakcíny Comirnaty. Příjemci vakcíny nehlásili zvýšení reaktogenity ani nežádoucí účinky.
V případě předávkování se doporučuje sledovat základní životní funkce a případně zahájit symptomatickou léčbu.
5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: vakcíny, jiné virové vakcíny, ATC kód: J07BX03
Mechanismus účinku
Mediátorová (messenger) RNA s modifikovanými nukleosidy je ve vakcíně Comirnaty zapouzdřená v lipidových nanočásticích, což umožňuje transfer nereplikující RNA do hostitelských buněk pro přímou přechodnou expresi S antigenu viru SARS-CoV-2. mRNA kóduje v membráně ukotvený S v plné délce se dvěma bodovými mutacemi v centrální šroubovici. Mutace těchto dvou aminokyselin na prolin uzamyká S v antigenně preferované prefuzní konformaci. Vakcína vyvolává jak odpověď neutralizačních protilátek, tak i imunitní odpověď buněk na spike (S) antigen, což může přispívat
k ochraně před onemocněním COVID-19.
Účinnost
Studie 2 je multicentrická, mezinárodní, randomizovaná, placebem kontrolovaná studie fáze 1/2/3 zaslepená pro pozorovatele, která hodnotí dávku, výběr vakcíny a její účinnost u účastníků ve věku 12 let a starších. Randomizace byla stratifikována podle věku: věk 12 až 15 let, věk 16 až 55 let a věk 56 let a více; do věkové skupiny ≥ 56 let spadalo minimálně 40 % účastníků. Ze studie byli vyřazeni imunokompromitovaní účastníci a osoby, u nichž byla dříve stanovena klinická či mikrobiologická
diagnóza onemocnění COVID-19. Účastníci s preexistujícími stabilizovanými onemocněními, definovanými jako onemocnění, jež během 6 týdnů před zařazením nevyžadovala významnou změnu léčby nebo hospitalizaci z důvodu zhoršení nemoci, byli do studie zařazeni stejně jako účastníci se známou stabilizovanou infekcí virem lidské imunodeficience (HIV), virem hepatitidy C (HCV) nebo virem hepatitidy B (HBV).
Účinnost u osob ve věku 16 let a starších – po 2 dávkách
Během fáze 2/3 Studie 2 bylo na základě dat získaných do 14. listopadu 2020 ve stejném poměru randomizováno zhruba 44 000 účastníků a byly jim podány 2 dávky mRNA vakcíny proti onemocnění COVID-19 nebo placeba. Analýzy účinnosti zahrnovaly účastníky, kteří dostali druhou dávku vakcíny v rozmezí 19 až 42 dnů po první dávce vakcíny. Většina (93,1 %) příjemců vakcíny dostala druhou dávku 19 dnů až 23 dnů po první dávce. Pro účely hodnocení bezpečnosti a účinnosti vakcíny proti onemocnění COVID-19 budou na základě připraveného plánu účastníci dále sledováni po dobu až 24 měsíců po 2. dávce. V klinické studii bylo od účastníků vyžadováno dodržení minimálního intervalu 14 dní před a po podání vakcíny proti chřipce, aby dostali buď placebo nebo mRNA vakcínu
proti onemocnění COVID-19. V klinické studii bylo od účastníků vyžadováno dodržení minimálního intervalu 60 dní před nebo po podání přípravků z krve/plazmy nebo imunoglobulinů v průběhu studie, aby dostali buď placebo nebo mRNA vakcínu proti onemocnění COVID-19.
Do populace pro analýzu primárního cílového parametru účinnosti bylo zařazeno 36 621 účastníků ve věku 12 let a starších (18 242 ve skupině s mRNA vakcínou proti onemocnění COVID-19 a 18 379 ve skupině s placebem), u nichž se během 7 dní po podání druhé dávky neprokázala předchozí infekce SARS-CoV-2. Kromě toho bylo 134 účastníků ve věku od 16 do 17 let (66 ve skupině s mRNA vakcínou proti onemocnění COVID-19 a 68 ve skupině s placebem) a 1 616 účastníků ve věku 75 let a starších (804 ve skupině s mRNA vakcínou proti onemocnění COVID-19 a 812 ve skupině s placebem).
V čase provedení primární analýzy účinnosti byli účastníci ve skupině mRNA vakcíny proti onemocnění COVID-19 sledováni z hlediska symptomatického onemocnění COVID-19 po celkovou dobu 2 214 osoboroků, účastníci ve skupině s placebem po dobu minimálně 2 222 osoboroků.
U účastníků s rizikem závažného onemocnění COVID-19, včetně osob s 1 nebo více komorbiditami, které riziko závažného onemocnění COVID-19 zvyšují (např. astma, index tělesné hmotnosti (BMI) ≥ 30 kg/m2, chronické plicní onemocnění, diabetes mellitus, hypertenze), nebyly zjištěny žádné významné klinické rozdíly v celkové účinnosti vakcíny.
Účinnost vakcíny mRNA proti onemocnění COVID-19 v prevenci prvního výskytu onemocnění
COVID-19 po 7 dnech po 2. dávce ve srovnání s placebem 94,6 % (95% interval spolehlivosti 89,6 % až 97,6 %) u účastníků ve věku 16 let a starších s nebo bez důkazů o předchozí infekci virem SARSCoV-2.
Analýzy podskupin primárního cílového parametru účinnosti navíc ukázaly podobné odhady bodů účinnosti u pohlaví, etnických skupin a účastníků s komorbiditami spojenými s vysokým rizikem závažného onemocnění COVID-19.
Byly provedeny aktualizované analýzy účinnosti s dalšími potvrzenými případy COVID-19, které se objevily během zaslepeného placebem kontrolovaného sledování, což v populaci s účinností představuje až 6 měsíců po podání 2. dávky.
V aktualizované analýze účinnosti byla účinnost mRNA vakcíny proti onemocnění COVID-19 v prevenci prvního výskytu onemocnění COVID-19 od 7 dnů po podání 2. dávky ve srovnání s placebem 91,1 % (95% CI 88,8 % až 93,0 %) u účastníků v hodnotitelné populaci účinnosti s průkazem nebo bez průkazu předchozí infekce SARS-CoV-2.
Aktualizované analýzy účinnosti podle podskupin navíc ukázaly podobné bodové odhady účinnosti u všech pohlaví, etnických skupin, zeměpisných oblastí a účastníků se zdravotními komorbiditami a obezitou spojenou s vysokým rizikem závažného onemocnění COVID-19.
Účinnost proti závažnému onemocnění COVID 19
Aktualizované analýzy účinnosti sekundárních cílových parametrů účinnosti podpořily přínos mRNA vakcíny proti onemocnění COVID-19 v prevenci závažného onemocnění COVID-19.
Od 13. března 2021 je účinnost vakcíny proti závažnému onemocnění COVID-19 prezentována pouze pro účastníky s předchozí infekcí SARS-CoV-2 nebo bez ní (tabulka 4), protože počty případů onemocnění COVID-19 u účastníků bez předchozí infekce SARS-CoV-2 byly stejné jako u účastníků s předchozí infekcí SARS-CoV-2 nebo bez ní jak ve skupině s mRNA vakcínou proti onemocnění COVID 19, tak ve skupině s placebem.
Účinnost a imunogenicita u dospívajících ve věku 12 až 15 let – po 2 dávkách
V analýze Studie 2 u dospívajících ve věku 12 až 15 let bez průkazu prodělané infekce nebyly žádné případy u 1 005 účastníků, kteří dostali vakcínu, a 16 případů z 978 účastníků, kteří dostali placebo.
Bodový odhad účinnosti je 100 % (95% interval spolehlivosti 75,3; 100,0). U účastníků s nebo bez průkazu prodělané infekce bylo 0 případů z 1 119 účastníků, kteří dostali vakcínu, a 18 případů z 1 110 účastníků, kteří dostali placebo. To také naznačuje, že bodový odhad účinnosti je 100 % (95% interval spolehlivosti 78,1; 100,0).
Ve Studii 2 byla provedena analýza neutralizačních titrů SARS-CoV-2 jeden měsíc po druhé dávce u náhodně vybrané podskupiny účastníků, kteří do 1 měsíce po dávce 2 neměli sérologické nebo virologické průkazy prodělané infekce SARS CoV-2, která porovnávala odpověď u dospívajících ve věku 12 až 15 let (n = 190) s účastníky ve věku 16 až 25 let (n = 170).
Poměr geometrických průměrných titrů (GMT) ve skupině ve věku 12 až 15 let ke skupině ve věku 16 až 25 let byl 1,76; s oboustranným 95% CI 1,47 až 2,10. Proto bylo splněno 1,5násobné kritérium neinferiority, protože dolní mez 2stranného 95% CI pro poměr geometrického průměru [GMR] byla > 0,67.
Imunogenicita u účastníků ve věku 18 let a starších – po posilovací dávce (třetí dávka) Účinnost posilovací dávky vakcíny Comirnaty byla založena na hodnocení 50% neutralizačních titrů protilátek (NT50) proti SARS-CoV-2 (USA_WA1/2020). Ve studii 2 prokázaly analýzy NT50 1 měsíc po posilovací dávce v porovnání s 1 měsícem po primární sérii u jedinců ve věku 18 až 55 let, kteří neměli žádné sérologické nebo virologické důkazy o prodělané infekci virem SARS CoV-2 do 1 měsíce po posilovací vakcinaci, noninferioritu jak pro geometrický průměrný poměr (GMR), tak pro rozdíl v četnostech sérologické odpovědi. Sérologická odpověď u účastníka byla definována jako
dosažení ≥ 4násobného zvýšení NT50 oproti výchozímu stavu (před primární sérií). Tyto analýzy jsou shrnuty v tabulce 5.
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s vakcínou Comirnaty u pediatrické populace k prevenci onemocnění COVID-19 (informace o použití u dětí viz bod 4.2).
Tento léčivý přípravek byl registrován postupem tzv. podmínečného schválení. Znamená to, že jsou očekávány další důkazy o jeho přínosech. Evropská agentura pro léčivé přípravky nejméně jednou za rok vyhodnotí nové informace o tomto léčivém přípravku a tento souhrn údajů o přípravku bude podle potřeby aktualizován.
5.2 Farmakokinetické vlastnosti Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti Neklinické údaje získané na základě konvenčních studií toxicity po opakovaném podávání a reprodukční a vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
Obecná toxicita
U potkanů, kterým byla intramuskulárně podávána vakcína Comirnaty (dostali 3 plné dávky pro člověka jednou týdně, které vedly k relativně vyšším hladinám u potkanů v důsledku rozdílů v tělesné hmotnosti), se vyskytl edém a erytém v místě podání injekce a zvýšení počtu bílých krvinek (včetně bazofilů a eozinofilů) odpovídající zánětlivé odpovědi a rovněž vakuolizace portálních hepatocytů bez známek poškození jater. Všechny účinky byly reverzibilní.
Genotoxicita / karcinogenita
Studie genotoxicity ani kancerogenity nebyly provedeny. U složek vakcíny (lipidy a mRNA) se neočekává genotoxický potenciál.
Reprodukční toxicita
Reprodukční a vývojová toxicita byla hodnocena na potkanech v kombinované studii fertility a vývojové toxicity, ve které byla samicím potkanů podána intramuskulárně vakcína Comirnaty před pářením a během březosti (dostaly 4 plné dávky pro člověka, které vedly k relativně vyšším hladinám u potkanů v důsledku rozdílů v tělesné hmotnosti mezi 21. dnem před pářením a 20. dnem březosti).
Odpovědi na neutralizační protilátky SARS-CoV-2 byly přítomny u samic před pářením až do konce studie ve 21. postnatálním dni a rovněž u plodů a potomků. Nebyly zjištěny žádné účinky spojené s očkováním na plodnost samic, těhotenství nebo vývoj embrya/plodu nebo potomstva. Údaje o možném placentárním přenosu nebo vylučování do mateřského mléka pro vakcínu Comirnaty nejsou k dispozici.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek ((4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) (ALC-0315)
2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide (ALC-0159)
Kolfosceryl-stearát
Cholesterol
Chlorid draselný
Dihydrogenfosforečnan draselný
Chlorid sodný
Dihydrát hydrogenfosforečnanu sodného
Sacharosa
Voda pro injekci
6.2 Inkompatibility Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti Neotevřená injekční lahvička
Zmrazená injekční lahvička
9 měsíců při teplotě -90 °C až -60 °C
Během doby použitelnosti 9 měsíců mohou být neotevřené injekční lahvičky uchovávány a
transportovány při teplotě -25 °C až -15 °C po jednotlivou dobu až 2 týdny a mohou být vráceny do prostoru pro uchovávání při teplotě -90 °C až -60 °C.
Rozmrazená injekční lahvička
1 měsíc při teplotě 2 °C až 8 °C
Během doby použitelnosti trvající 1 měsíc při teplotě 2 °C až 8 °C lze přípravek transportovat až po dobu 12 hodin.
Neotevřenou injekční lahvičku lze před použitím uchovávat až 2 hodiny při teplotě do 30 °C.
Po rozmrazení vakcína nesmí být znovu zmrazena.
Manipulace při teplotních výkyvech po jednorázovém vyjmutí z mrazničky
Údaje o stabilitě prokazují, že je neotevřená injekční lahvička stabilní až:
• 24 hodin, je-li uchovávána při teplotě od -3 °C do 2 °C,
• celkem 4 hodiny, je-li uchovávána při teplotě od 8 °C do 30 °C; to zahrnuje 2 hodiny při teplotě až do 30 °C, jak je uvedeno výše
Tyto informace slouží jako návod pro zdravotnické pracovníky pouze v případě dočasného výkyvu teploty.
Přenesení zmrazených injekčních lahviček uchovávaných při velmi nízké teplotě (< -60 °C)
• Zásobníky injekčních lahviček uzavřené víkem obsahující 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání při velmi nízké teplotě ve zmrazeném stavu (< -60 °C), smí být uchovávány maximálně 5 minut při teplotě až 25 °C.
• Zásobníky injekčních lahviček s otevřeným víkem nebo zásobníky injekčních lahviček obsahující méně než 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání při velmi nízké teplotě ve zmrazeném stavu (< -60 °C), smí být uchovávány maximálně 3 minuty při teplotě až 25 °C.
• Poté, co jsou zásobníky s injekčními lahvičkami vráceny do prostoru pro uchovávání ve zmrazeném stavu po vystavení teplotě až 25 °C, musí zůstat ve zmrazeném stavu po dobu nejméně 2 hodin než je lze znovu vyjmout.
Přenesení zmrazených injekčních lahviček uchovávaných při teplotě -25 °C až -15 °C
• Zásobníky injekčních lahviček uzavřené víkem obsahující 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání ve zmrazeném stavu (-25 °C až -15 °C), smí být uchovávány maximálně 3 minuty při teplotě až 25 °C.
• Zásobníky injekčních lahviček s otevřeným víkem nebo zásobníky injekčních lahviček
obsahující méně než 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání ve zmrazeném stavu (-25 °C až -15 °C), smí být uchovávány maximálně 1 minutu při teplotě až 25 °C.
Jakmile je injekční lahvička vyjmuta ze zásobníku na injekční lahvičky, má být rozmrazena pro použití.
Zředěný léčivý přípravek
Chemická a fyzikální stabilita po otevření před použitím, včetně doby transportu, byla prokázána po dobu 6 hodin při teplotě 2 °C až 30 °C po naředění injekčním roztokem chloridu sodného 9 mg/ml (0,9%). Z mikrobiologického hlediska, pokud způsob ředění nevyloučí riziko mikrobiologické kontaminace, má být přípravek použit okamžitě. Pokud není použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v mrazničce při teplotě -90 °C až -60 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Během uchovávání je třeba minimalizovat vystavení přípravku světlu v místnosti a zabránit vystavení přímému slunečnímu světlu a ultrafialovému světlu. S rozmrazenými injekčními lahvičkami lze manipulovat za podmínek světla v místnosti.
Podmínky uchovávání tohoto léčivého přípravku po jeho rozmrazení a naředění jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení 2ml, čirá, vícedávková injekční lahvička (sklo třídy I) se zátkou (syntetická brombutylová pryž) a odtrhovacím plastovým víčkem s hliníkovým krytem. Jedna injekční lahvička obsahuje 6 dávek, viz bod 6.6.
Velikost balení: 195 injekčních lahviček
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Instrukce pro zacházení s vakcínou
Vakcína Comirnaty má být připravována zdravotnickým pracovníkem pomocí aseptické techniky, aby byla zajištěna sterilita připravené disperze.
ROZMRAZENÍ PŘED ŘEDĚNÍM
• Vícedávková injekční lahvička se uchovává zmrazená a před ředěním se musí rozmrazit. Zmrazené injekční lahvičky je třeba přenést do prostředí o teplotě 2 °C až 8 °C, aby se rozmrazily. Rozmrazení balení 195 injekčních lahviček může trvat 3 hodiny. Alternativně lze zmrazené injekční lahvičky rozmrazovat po dobu 30 minut při teplotě do 30 °C pro okamžité použití.
• Neotevřenou injekční lahvičku lze uchovávat až 1 měsíc při teplotě 2 °C až 8 °C. Během doby použitelnosti trvající 1 měsíc při teplotě 2 °C až 8 °C lze přípravek transportovat až po dobu 12 hodin.
• Rozmrazenou injekční lahvičku nechejte dosáhnout pokojové teploty a před ředěním ji 10krát jemně převraťte. Lahvičkou netřepejte.
• Před naředěním může rozmrazená disperze obsahovat bílé až téměř bílé neprůhledné amorfní částice.
ŘEDĚNÍ
• Rozmrazená vakcína se musí naředit v původní injekční lahvičce 1,8 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%) za použití jehly o velikosti 21 gauge (21G) nebo užší a uplatnění aseptických metod. Ne déle než 2 hodiny při pokojové teplotě
(do 30 °C).
• Nasátím 1,8 ml vzduchu do prázdné stříkačky na rozpouštědlo vyrovnejte před vyjmutím jehly z injekční lahvičky tlak v injekční lahvičce.
• Disperzi 10krát jemně převraťte. Lahvičkou netřepejte.
• Naředěná vakcína se má jevit jako téměř bílá disperze bez viditelných částic. Jestliže jsou v naředěné vakcíně patrné částice nebo vakcína změnila barvu, nepoužívejte ji. Vytáhněte píst na značku 1,8 ml pro odstranění vzduchu z injekční
lahvičky.
• Injekční lahvičky s naředěnou vakcínou je třeba označit příslušným datem a časem.
• Po naředění uchovávejte vakcínu při teplotě 2 °C až 30 °C a použijte ji během 6 hodin, včetně doby transportu.
• Naředěnou disperzi nezmrazujte ani s ní netřepejte. Pokud je v chladu, nechte
naředěnou disperzi před použitím dosáhnout pokojové teploty.
PŘÍPRAVA JEDNOTLIVÝCH DÁVEK O OBJEMU 0,3 ml VAKCÍNY COMIRNATY
• Po naředění obsahuje injekční lahvička 2,25 ml, ze kterých lze získat 6 dávek
po 0,3 ml.
• Pomocí aseptické techniky očistěte zátku injekční lahvičky použitím antiseptického tampónu.
• Natáhněte 0,3 ml vakcíny Comirnaty. K získání šesti dávek z jedné injekční
lahvičky je třeba použít injekční stříkačky a/nebo jehly s malým mrtvým prostorem. Kombinace injekční stříkačky a jehly s malým mrtvým prostorem má mít mrtvý objem
maximálně 35 mikrolitrů. Pokud se používají standardní injekční stříkačky a jehly, nemusí být zajištěn dostatečný objem k získání šesté dávky z jedné injekční lahvičky.
• Každá dávka musí obsahovat 0,3 ml vakcíny.
• Pokud množství vakcíny zbývající v injekční lahvičce nemůže poskytnout plnou dávku 0,3 ml, injekční lahvičku a veškerý přebytečný objem zlikvidujte.
• Veškerou vakcínu, jež nebyla použita do 6 hodin po naředění, zlikvidujte. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními
požadavky.
Zaznamenejte příslušné datum a čas.
Použijte během 6 hodin po naředění.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI BioNTech Manufacturing GmbH
An der Goldgrube 12
55131 Mainz
Německo
tel.: +49 6131 9084-0
fax: +49 6131 9084-2121
service@biontech.de
8. REGISTRAČNÍ ČÍSLO/REGISTRAČNÍ ČÍSLA EU/1/20/1528/001
9. DATUM REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: 21. prosince 2020
10. DATUM REVIZE TEXTU Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/
PŘÍLOHA II
A. VÝROBCI BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO
PŘÍPRAVKU
E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO PODMÍNEČNOU REGISTRACI
PŘÍPRAVKU
A. VÝROBCI BIOLOGICKÝCH LÉČIVÝCH LÁTEK A VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ
Název a adresa výrobců biologické léčivé látky/biologických léčivých látek
BioNTech Manufacturing GmbH
An der Goldgrube 12
55131 Mainz
Německo
BioNTech Manufacturing Marburg GmbH
Emil-von-Behring-Strasse 76
35401 Marburg
Německo
Rentschler Biopharma SE
Erwin-Rentschler-Strasse 21
88471 Laupheim
Německo
Wyeth BioPharma Division of Wyeth Pharmaceuticals LLC
1 Burtt Road
Andover, MA 01810
USA
Název a adresa výrobců odpovědných za propouštění šarží BioNTech Manufacturing GmbH
Kupferbergterrasse 17-19
55116 Mainz
Německo
Pfizer Manufacturing Belgium NV
Rijksweg 12
2870 Puurs
Belgie
V příbalové informaci k léčivému přípravku musí být uveden název a adresa výrobce odpovědného za propouštění dané šarže.
S ohledem na deklarovanou naléhavou situaci v oblasti veřejného zdraví mezinárodního zájmu a s cílem zajistit včasné dodání podléhá tento léčivý přípravek časově omezené výjimce, která umožňuje spoléhat se na kontroly šarží prováděné v registrovaném místě/registrovaných místech, které/á se nacházejí ve třetí zemi. Tato výjimka pozbývá platnosti dne 31. srpna 2021. Implementace opatření pro kontrolu šarží v EU, včetně nezbytných změn podmínek rozhodnutí o registraci, musí být dokončena nejpozději do 31. srpna 2021 v souladu se schváleným plánem pro tento převod testování.
Zprávy o vývoji je třeba předložit 31. března 2021 a zahrnout je do žádosti o roční prodloužení.
B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ
Výdej léčivého přípravku je vázán na lékařský předpis.
• Úřední propouštění šarží
Podle článku 114 směrnice 2001/83/ES bude úřední propouštění šarží provádět některá státní laboratoř nebo laboratoř k tomuto účelu určená.
C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE
• Pravidelně aktualizované zprávy o bezpečnosti (PSUR)
Požadavky pro předkládání PSUR pro tento léčivý přípravek jsou uvedeny v seznamu
referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES
a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé
přípravky.
Držitel rozhodnutí o registraci (MAH) předloží první PSUR pro tento léčivý přípravek do 6 měsíců od jeho registrace.
D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU
• Plán řízení rizik (RMP)
Držitel rozhodnutí o registraci (MAH) uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu 1.8.2 registrace a ve veškerých schválených následných aktualizacích RMP.
Aktualizovaný RMP je třeba předložit:
• na žádost Evropské agentury pro léčivé přípravky,
• při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení
význačného milníku (v rámci farmakovigilance nebo minimalizace rizik).
E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO PODMÍNEČNOU REGISTRACI PŘÍPRAVKU
Tato registrace byla schválena postupem tzv. podmínečného schválení, a proto podle čl. 14-a odst. 4 nařízení (ES) č. 726/2004 držitel rozhodnutí o registraci uskuteční v daném termínu následující opatření:
Popis Termín splnění
Držitel rozhodnutí o registraci má za účelem dokončení charakterizace léčivé
látky a finálního přípravku poskytnout další údaje.
Červenec 2021.
Průběžné zprávy: 31. března 2021
V zájmu zajištění konzistentní kvality přípravku má držitel rozhodnutí o registraci poskytnout další informace ke zlepšení strategie kontroly, včetně specifikací léčivé látky a finálního přípravku.
Červenec 2021.
Průběžné zprávy: březen 2021
Za účelem potvrzení profilu čistoty a zajištění komplexní kontroly kvality a
konzistence mezi šaržemi během celého životního cyklu finálního přípravku má držitel rozhodnutí o registraci poskytnout další informace o syntetickém procesu a strategii kontroly pomocné látky ALC-0315.
Červenec 2021.
Průběžné zprávy: leden 2021, duben 2021.
Za účelem potvrzení profilu čistoty a zajištění komplexní kontroly kvality a
konzistence mezi šaržemi během celého životního cyklu finálního přípravku má držitel rozhodnutí o registraci poskytnout další informace o syntetickém procesu a strategii kontroly pomocné látky ALC-0159.
Červenec 2021.
Průběžné zprávy: leden 2021, duben 2021.
Popis Termín splnění
Za účelem potvrzení účinnosti a bezpečnosti přípravku Comirnaty má držitel rozhodnutí o registraci předložit závěrečnou zprávu o klinické studii pro randomizovanou, placebem kontrolovanou, pro pozorovatele zaslepenou klinickou studii C4591001.
Prosinec 2023
PŘÍLOHA III
OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
A. OZNAČENÍ NA OBALU
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
ŠTÍTEK NA KRABIČCE
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
COMIRNATY koncentrát pro injekční disperzi
mRNA vakcína proti onemocnění COVID-19 (modifikovaný nukleosid)
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna injekční lahvička obsahuje po naředění 6 dávek po 0,3 ml.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: ALC-0315, ALC-0159, kolfosceryl-stearát, cholesterol, chlorid draselný,
dihydrogenfosforečnan draselný, chlorid sodný, dihydrát hydrogenfosforečnanu sodného, sacharosa, voda pro injekci
4. LÉKOVÁ FORMA A OBSAH BALENÍ
Koncentrát pro injekční disperzi 195 vícedávkových injekčních lahviček
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Intramuskulární podání po naředění.
Před použitím si přečtěte příbalovou informaci.
Více informací je k dispozici po sejmutí QR kódu.
Před použitím nařeďte: Jednu injekční lahvičku nařeďte 1,8 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%).
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
Použitelnost při teplotě 2 °C až 8 °C: …………………..
(maximálně 1 měsíc; zajistěte, aby dřívější datum použitelnosti bylo nečitelné)
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
Uchovávání: Před naředěním uchovávejte při teplotě -90 °C až -60 °C v původním obalu, aby byl přípravek chráněn před světlem.
Po naředění vakcínu uchovávejte při teplotě 2 °C až 30 °C a použijte ji do 6 hodin. Případnou nepoužitou vakcínu zlikvidujte.
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
BioNTech Manufacturing GmbH
An der Goldgrube 12
55131 Mainz, Německo
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
EU/1/20/1528/001
13. ČÍSLO ŠARŽE
Lot
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
16. INFORMACE V BRAILLOVĚ PÍSMU
Nevyžaduje se – odůvodnění přijato.
17. JEDINEČNÝ IDENTIFIKÁTOR – 2D ČÁROVÝ KÓD
2D čárový kód s jedinečným identifikátorem.
18. JEDINEČNÝ IDENTIFIKÁTOR – DATA ČITELNÁ OKEM
PC
SN
NN
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU
ŠTÍTEK NA INJEKČNÍ LAHVIČCE
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ
COMIRNATY sterilní koncentrát
mRNA vakcína proti onemocnění COVID-19
i.m.
2. ZPŮSOB PODÁNÍ
3. POUŽITELNOST
EXP
4. ČÍSLO ŠARŽE
Lot
5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET
6 dávek po naředění
6. JINÉ
Datum/čas likvidace:
B. PŘÍBALOVÁ INFORMACE
Příbalová informace: informace pro uživatele
Comirnaty koncentrát pro injekční disperzi
mRNA vakcína proti onemocnění COVID-19 (modifikovaný nukleosid)
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4.
Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tato vakcína podána, protože obsahuje pro Vás důležité údaje.
• Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu.
• Máte-li jakékoli další otázky, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
• Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4.
Co naleznete v této příbalové informaci
1. Co je vakcína Comirnaty a k čemu se používá
2. Čemu musíte věnovat pozornost, než Vám bude vakcína Comirnaty podána
3. Jak se vakcína Comirnaty podává
4. Možné nežádoucí účinky
5. Jak vakcínu Comirnaty uchovávat
6. Obsah balení a další informace
1. Co je vakcína Comirnaty a k čemu se používá
Comirnaty je vakcína používaná pro prevenci onemocnění COVID-19, které způsobuje virus SARSCoV-2.
Vakcína Comirnaty se podává dospělým a dospívajícím ve věku 12 let a starším.
Vakcína způsobuje, že imunitní systém (přirozená obrana těla) vytváří protilátky a krevní buňky, které působí proti viru, a tím chrání před onemocněním COVID-19.
Jelikož vakcína Comirnaty neobsahuje virus k vyvolání imunity, nemůže u Vás vyvolat onemocnění COVID-19.
2. Čemu musíte věnovat pozornost, než Vám bude vakcína Comirnaty podána
Vakcína Comirnaty Vám nesmí být podána
• jestliže jste alergický(á) na léčivou látku nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6).
Upozornění a opatření
Před podáním vakcíny se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou, jestliže:
• jste někdy měl(a) závažnou alergickou reakci nebo potíže s dýcháním po jakékoli jiné vakcíně podané v injekci nebo poté, co Vám byla v minulosti podána vakcína Comirnaty,
• jste v souvislosti s očkováním nervózní nebo jste někdy po jakékoli injekci omdlel(a),
• máte závažné onemocnění nebo infekci s vysokou horečkou. Avšak očkování můžete
podstoupit, pokud máte mírně zvýšenou teplotu nebo lehkou infekci horních cest dýchacích, jako je nachlazení,
• máte krvácivé potíže, lehce se Vám tvoří modřiny nebo užíváte lék, který zabraňuje srážení krve,
• máte oslabený imunitní systém, kvůli onemocnění, jako je infekce virem HIV, nebo užíváte lék, jako je kortikosteroid, který imunitní systém ovlivňuje.
Po očkování vakcínou Comirnaty byly velmi vzácně hlášeny případy myokarditidy (zánětu srdečního svalu) a perikarditidy (zánětu osrdečníku (perikardu)). K těmto případům dochází zejména do dvou týdnů po očkování, častěji po druhé dávce vakcíny, a častěji k nim dochází u mladších mužů. Po očkování na sobě pozorně sledujte příznaky myokarditidy a perikarditidy, například dušnost, silný tlukot srdce a bolest na hrudi, a pokud se u Vás vyskytnou, ihned vyhledejte lékařskou pomoc.
Podobně jako u jiných vakcín je možné, že vakcína Comirnaty nebude plně chránit všechny osoby, kterým bude vakcína podána a není známo, jak dlouho budou chráněny.
Můžete dostat třetí dávku vakcíny Comirnaty. Třetí dávka ještě nemusí zajistit plnou imunitu proti onemocnění COVID-19 u osob se sníženou imunitou. V těchto případech byste měl(a) i nadále dodržovat preventivní opatření, která pomáhají předcházet onemocnění COVID-19. Kromě toho by měly být podle potřeby očkovány i Vaše blízké kontakty. Proberte příslušná individuální doporučení se svým lékařem.
Děti
Vakcína Comirnaty není určena pro děti a dospívající ve věku do 12 let.
Další léčivé přípravky a vakcína Comirnaty
Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat, a o tom, zda Vám byla v nedávné době podána jiná vakcína.
Těhotenství a kojení
Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než Vám bude tato vakcína podána.
Řízení dopravních prostředků a obsluha strojů
Některé účinky očkování uvedené v bodě 4 (Možné nežádoucí účinky) mohou dočasně ovlivnit Vaši schopnost řídit nebo obsluhovat stroje. Před řízením nebo obsluhou strojů počkejte, dokud tyto účinky neodezní.
Vakcína Comirnaty obsahuje draslík a sodík
Tato vakcína obsahuje méně než 1 mmol (39 mg) draslíku v jedné dávce, to znamená, že je v podstatě „bez draslíku“.
Tato vakcína obsahuje méně než 1 mmol (23 mg) sodíku v jedné dávce, to znamená, že je v podstatě „bez sodíku“.
3. Jak se vakcína Comirnaty podává
Vakcína Comirnaty se podává po naředění jako injekce o objemu 0,3 ml do svalu v horní části paže.
Budou Vám podány 2 injekce.
Doporučuje se, abyste druhou dávku téže vakcíny dostal(a) 3 týdny po první dávce pro dokončení očkovacího cyklu.
Posilovací dávka (třetí dávka) vakcíny Comirnaty může být podána nejméně 6 měsíců po druhé dávce u osob ve věku 18 let a starších.
Pokud máte oslabenou imunitu, můžete dostat třetí dávku vakcíny Comirnaty nejméně 28 dní po druhé dávce.
Máte-li jakékoli další otázky týkající se používání vakcíny Comirnaty, zeptejte se svého lékaře, lékárníka nebo zdravotní sestry.
4. Možné nežádoucí účinky
Podobně jako všechny vakcíny může mít i vakcína Comirnaty nežádoucí účinky, které se ale nemusí
vyskytnout u každého.
Nežádoucí účinky se mohou vyskytnout s následující četností:
Velmi časté nežádoucí účinky: mohou postihnout více než 1 z 10 lidí
• v místě injekce: bolest, zduření
• únava
• bolest hlavy
• bolest svalů
• zimnice
• bolest kloubů
• průjem
• horečka
Některé z těchto nežádoucích účinků se o něco častěji vyskytovaly u dospívajících ve věku 12 až 15 let než u dospělých.
Časté nežádoucí účinky: mohou postihnout až 1 z 10 lidí
• zarudnutí v místě injekce
• pocit na zvracení
• zvracení
Méně časté nežádoucí účinky: mohou postihnout až 1 ze 100 lidí
• zvětšené mízní uzliny (častěji pozorované po posilovací dávce)
• malátnost
• bolest paže
• nespavost
• svědění v místě injekce
• alergické reakce, jako je vyrážka nebo svědění
• pocit slabosti nebo nedostatku energie/ospalost
• snížená chuť k jídlu
• nadměrné pocení
• noční pocení
Vzácné nežádoucí účinky: mohou postihnout až 1 z 1 000 lidí
• dočasná jednostranná obrna lícního nervu
• alergické reakce, jako je kopřivka nebo otok obličeje
Není známo (z dostupných údajů nelze určit)
• závažná alergická reakce
• zánět srdečního svalu (myokarditida) nebo zánět osrdečníku (perikardu) (perikarditida), který může vést k dušnosti, silnému tlukotu srdce nebo bolest na hrudi
• rozsáhlý otok končetiny, do které byla vakcína podána
• otok obličeje (otok obličeje se může objevit u pacientů, kterým byly do obličeje aplikovány injekce kožních výplní)
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného Dodatku V. Uveďte přitom číslo šarže, je-li k dispozici. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak vakcínu Comirnaty uchovávat
Uchovávejte tento přípravek mimo dohled a dosah dětí.
Následující informace o uchovávání, době použitelnosti a použití a manipulaci jsou určeny pro zdravotnické pracovníky.
Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a štítku za EXP.
Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Uchovávejte v mrazničce při teplotě -90 °C až -60 °C. Během doby použitelnosti 9 měsíců mohou být neotevřené injekční lahvičky uchovávány a transportovány při teplotě -25 °C až -15 °C po jednotlivou dobu až 2 týdny a mohou být vráceny do prostoru pro uchovávání při teplotě -90 °C až -60 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Přenesení zmrazených injekčních lahviček uchovávaných při velmi nízké teplotě (< -60 °C)
• Zásobníky injekčních lahviček uzavřené víkem obsahující 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání při velmi nízké teplotě ve zmrazeném stavu (< -60 °C), smí být uchovávány maximálně 5 minut při teplotě až 25 °C.
• Zásobníky injekčních lahviček s otevřeným víkem nebo zásobníky injekčních lahviček
obsahující méně než 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání při velmi nízké teplotě ve zmrazeném stavu (< -60 °C), smí být uchovávány maximálně 3 minuty při teplotě až 25 °C.
• Poté, co jsou zásobníky s injekčními lahvičkami vráceny do prostoru pro uchovávání ve zmrazeném stavu po vystavení teplotě až 25 °C, musí zůstat ve zmrazeném stavu po dobu nejméně 2 hodin než je lze znovu vyjmout.
Přenesení zmrazených injekčních lahviček uchovávaných při teplotě -25 °C až -15 °C
• Zásobníky injekčních lahviček uzavřené víkem obsahující 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání ve zmrazeném stavu (-25 °C až -15 °C), smí být uchovávány maximálně 3 minuty při teplotě až 25 °C.
• Zásobníky injekčních lahviček s otevřeným víkem nebo zásobníky injekčních lahviček
obsahující méně než 195 injekčních lahviček, které byly vyjmuty z prostoru pro uchovávání ve zmrazeném stavu (-25 °C až -15 °C), smí být uchovávány maximálně 1 minutu při teplotě až 25 °C.
Jakmile je injekční lahvička vyjmuta ze zásobníku na injekční lahvičky, má být rozmrazena pro použití.
Po rozmrazení se má vakcína naředit a okamžitě použít. Údaje o stabilitě v době používání prokázaly, že po vyjmutí z mrazáku lze neředěnou vakcínu před použitím uchovávat po dobu až 1 měsíce při teplotě 2 °C až 8 °C. Během doby použitelnosti trvající 1 měsíc při teplotě 2 °C až 8 °C lze přípravek transportovat až po dobu 12 hodin. Neotevřenou vakcínu lze před použitím uchovávat po dobu až 2 hodin při teplotách do 30 °C.
Po naředění vakcínu uchovávejte a transportujte při teplotě 2 °C až 30 °C a použijte ji do 6 hodin.
Případnou nepoužitou vakcínu zlikvidujte.
Po jednorázovém vyjmutí z mrazničky a naředění se mají injekční lahvičky označit novým datem a časem pro likvidaci. Po jednorázovém rozmrazení se vakcína nesmí znovu zmrazit.
Vakcínu nepoužívejte, pokud si všimnete, že jsou v naředěném roztoku částice nebo že roztok změnil barvu.
Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co vakcína Comirnaty obsahuje
• Léčivou látkou je mRNA vakcína proti onemocnění COVID-19. Po naředění obsahuje injekční lahvička 6 dávek po 0,3 ml s 30 mikrogramy mRNA v každé dávce.
• Dalšími složkami jsou:
- ((4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) (ALC-0315)
- 2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide (ALC-0159)
- kolfosceryl-stearát
- cholesterol
- chlorid draselný
- dihydrogenfosforečnan draselný
- chlorid sodný
- dihydrát hydrogenfosforečnanu sodného
- sacharosa
- voda pro injekci
Jak vakcína Comirnaty vypadá a co obsahuje toto balení
Vakcína je bílá až téměř bílá disperze (pH: 6,9–7,9), která se dodává ve vícedávkové čiré 2ml injekční lahvičce (sklo třídy I) obsahující 6 dávek. Injekční lahvička je uzavřena pryžovou zátkou a odtrhovacím plastovým víčkem s hliníkovým krytem.
Velikost balení: 195 injekčních lahviček
Držitel rozhodnutí o registraci
BioNTech Manufacturing GmbH
An der Goldgrube 12
55131 Mainz
Německo
tel.: +49 6131 9084-0
fax: +49 6131 9084-2121
service@biontech.de
Výrobci
BioNTech Manufacturing GmbH
Kupferbergterrasse 17-19
55116 Mainz
Německo
Pfizer Manufacturing Belgium NV
Rijksweg 12
2870 Puurs
Belgie
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
België/Belgique/Belgien
Luxembourg/Luxemburg
Pfizer S.A./N.V.
Tél/Tel: +32 (0)2 554 62 11
Lietuva
Pfizer Luxembourg SARL filialas Lietuvoje
Tel. +370 52 51 4000
България
Пфайзер Люксембург САРЛ, Клон
България
Teл: +359 2 970 4333
Magyarország
Pfizer Kft
Tel: +36 1 488 3700
Česká republika
Pfizer, spol. s r.o.
Tel: +420 283 004 111
Malta
Vivian Corporation Ltd.
Tel: +35621 344610
Danmark
Pfizer ApS
Tlf: +45 44 201 100
Norge
Pfizer AS
Tlf: +47 67 526 100
Deutschland
BioNTech Manufacturing GmbH
Tel: +49 6131 90840
Nederland
Pfizer BV
Tel: +31 (0)10 406 43 01
Eesti
Pfizer Luxembourg SARL Eesti filiaal
Tel: +372 666 7500
Österreich
Pfizer Corporation Austria Ges.m.b.H
Tel: +43 (0)1 521 15-0
Ελλάδα
Pfizer Ελλάς A.E.
Τηλ.: +30 210 6785 800
Polska
Pfizer Polska Sp. z o.o.
Tel.: +48 22 335 61 00
España
Pfizer, S.L.
Tél:+34914909900
Portugal
Laboratórios Pfizer, Lda.
Tel: +351 21 423 5500
France
Pfizer
Tél +33 1 58 07 34 40
România
Pfizer Romania S.R.L
Tel: +40 (0) 21 207 28 00
Hrvatska
Pfizer Croatia d.o.o.
Tel: +385 1 3908 777
Slovenija
Pfizer Luxembourg SARL
Pfizer, podružnica za svetovanje s področja
farmacevtske dejavnosti, Ljubljana
Tel.: +386 (0) 1 52 11 400
Ireland
Pfizer Healthcare Ireland
Tel: 1800 633 363 (toll free)
+44 (0)1304 616161
Slovenská republika
Pfizer Luxembourg SARL,
organizačná zložka
Tel: +421 2 3355 5500
Ísland
Icepharma hf
Simi: +354 540 8000
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 430 040
Italia
Pfizer S.r.l.
Tel: +39 06 33 18 21
Sverige
Pfizer AB
Tel: +46 (0)8 550 520 00
Κύπρος
Pfizer Ελλάς Α.Ε. (Cyprus Branch)
Tηλ: +357 22 817690
United Kingdom (Northern Ireland)
Pfizer Limited
Tel: +44 (0) 1304 616161
Latvija
Pfizer Luxembourg SARL filiāle Latvijā
Tel.: +371 670 35 775
Tato příbalová informace byla naposledy revidována {MM/RRRR}
Tento léčivý přípravek byl registrován postupem tzv. podmínečného schválení. Znamená to, že jsou očekávány další důkazy o jeho přínosech. Evropská agentura pro léčivé přípravky nejméně jednou za rok vyhodnotí nové informace o tomto léčivém přípravku a tato příbalová informace bude podle potřeby aktualizována.
Pro zobrazení příbalové informace v různých jazycích sejměte následující kód pomocí chytrého zařízení.
URL: www.comirnatyglobal.com
Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky http://www.ema.europa.eu/
Na webových stránkách Evropské agentury pro léčivé přípravky je tato příbalová informace k dispozici ve všech úředních jazycích EU/EHP.
----------
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Podávejte vakcínu Comirnaty intramuskulárně po naředění jako primární cyklus 2 dávek (každá po 0,3 ml) s odstupem 3 týdnů. Posilovací dávka (třetí dávka) vakcíny Comirnaty může být podána nejméně 6 měsíců po druhé dávce u osob ve věku 18 let a starších.
Třetí dávka může být podána nejméně 28 dní po druhé dávce jedincům s těžkou poruchou imunity.
Sledovatelnost
Aby se zlepšila sledovatelnost biologických léčivých přípravků, má se přehledně zaznamenat název podaného přípravku a číslo šarže.
Instrukce pro zacházení s vakcínou
Vakcína Comirnaty má být připravována zdravotnickým pracovníkem pomocí aseptické techniky, abybyla zajištěna sterilita připravené disperze.
ROZMRAZENÍ PŘED ŘEDĚNÍM
• Vícedávková injekční lahvička se uchovává zmrazená a před ředěním se musí rozmrazit. Zmrazené injekční lahvičky je třeba přenést do prostředí o teplotě 2 °C až 8 °C, aby se rozmrazily. Rozmrazení balení 195 injekčních lahviček může trvat 3 hodiny. Alternativně lze zmrazené injekční lahvičky rozmrazovat po dobu 30 minut při teplotě do 30 °C pro okamžité použití.
• Neotevřenou injekční lahvičku lze uchovávat až 1 měsíc při teplotě 2 °C až 8 °C. Během doby použitelnosti trvající 1 měsíc při teplotě 2 °C až 8 °C lze přípravek transportovat až po dobu 12 hodin.
• Rozmrazenou injekční lahvičku nechejte dosáhnout pokojové teploty a před ředěním ji 10krát jemně převraťte. Lahvičkou netřepejte.
• Před naředěním může rozmrazená disperze obsahovat bílé až téměř bílé neprůhledné amorfní částice.
ŘEDĚNÍ
• Rozmrazená vakcína se musí naředit v původní injekční lahvičce 1,8 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%) za použití jehly o velikosti 21 gauge (21G) nebo užší a uplatnění aseptických metod. Ne déle než 2 hodiny při pokojové teplotě
(do 30 °C).
• Nasátím 1,8 ml vzduchu do prázdné stříkačky na rozpouštědlo vyrovnejte před vyjmutím jehly z injekční lahvičky tlak v injekční lahvičce.
• Disperzi 10krát jemně převraťte. Lahvičkou netřepejte.
• Naředěná vakcína se má jevit jako téměř bílá disperze bez viditelných částic. Jestliže jsou v naředěné vakcíně patrné částice nebo vakcína změnila barvu, nepoužívejte ji. Vytáhněte píst na značku 1,8 ml pro odstranění vzduchu z injekční
lahvičky.
• Injekční lahvičky s naředěnou vakcínou je třeba označit příslušným datem a časem.
• Po naředění uchovávejte vakcínu při teplotě 2 °C až 30 °C a použijte ji během 6 hodin, včetně doby transportu.
• Naředěnou disperzi nezmrazujte ani s ní netřepejte. Pokud je v chladu, nechte
naředěnou disperzi před použitím dosáhnout pokojové teploty.
PŘÍPRAVA JEDNOTLIVÝCH DÁVEK O OBJEMU 0,3 ml VAKCÍNY COMIRNATY
• Po naředění obsahuje injekční lahvička 2,25 ml, ze kterých lze získat 6 dávek
po 0,3 ml.
• Pomocí aseptické techniky očistěte zátku injekční lahvičky použitím antiseptického tampónu.
• Natáhněte 0,3 ml vakcíny Comirnaty.
K získání šesti dávek z jedné injekční lahvičky je třeba použít injekční stříkačky a/nebo jehly s malým mrtvým prostorem. Kombinace injekční stříkačky a jehly s malým mrtvým prostorem má mít mrtvý objem maximálně 35 mikrolitrů.
Pokud se používají standardní injekční stříkačky a jehly, nemusí být zajištěn
dostatečný objem k získání šesté dávky z jedné injekční lahvičky.
• Každá dávka musí obsahovat 0,3 ml vakcíny.
• Pokud množství vakcíny zbývající v injekční lahvičce nemůže poskytnout plnou dávku 0,3 ml, injekční lahvičku a veškerý přebytečný objem zlikvidujte.
• Veškerou vakcínu, jež nebyla použita do 6 hodin po naředění, zlikvidujte.
Likvidace
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Zdroj © Wahlgrenis

24.10.2021
Dobrý večer.
Koukal jsem, že máte na stránkách téma k v*kcínám, viz
Nepodávajú úplné informácie o zložení v*kcín .
Minulý týden jsem se ptal jednoho kolegy v práci, zda je očkovaný, není.
Říkal mi, že si to do sebe nedá nikdy píchnout.
Kamarád jeho, co žil u nich na domě, bylo mu kolem 40, tak se šel očkovat v dobré víře a druhý den ráno ho našli mrtvého v posteli.
Prý se potvrdilo, že zemřel díky reakci jeho imunního systému na vakcínu.
Samozřejmě argumenty pro vakcíny známe všichni.
A i to, že na očkování zemře jeden ze 100 tisíc nebo z milionu.
Že to je prostě statistika, aby se člověk nebál, že on ten jeden z milionu těžko bude...
Každá taková tragédie se marginalizuje díky statistice.
Ten člověk by dle mého, pokud by nebyl očkovaný a měl covid, tak by to asi přežil.
A nebo sem tam někdo řekne, že už to má za sebou, že to bylo pro blahovětšiny, tak není třeba nad ním truchlit.
Napadá mne více, co na to psát, ale myslím si, že to asi nemá smysl.
Málokterý člověk si alespoň na pár sekund představí, pokud byl očkovaný, že měl velké štěstí, že nedopadl jako jeden z milionu.
Při tom by bylo mnohem více etické, když člověk jde na očkování, aby mu bylo výslovně řečeno, že smrt z vakcíny nelze nikdy vyloučit, pokud nebude mít štěstí, protože je jen vysoce nepravděpodobná.
Aby se lidem nelhalo.
V současnosti se lidem lže, když jdou na očkování.
Ale chápu to.
Mluví se o těch pár, co nepřežilo očkování, jako o nějakých exotech, kteří to schytali, protože prostě nebyli lidmi.
A tak se zdůvodní, že není třeba tedy si dělat starosti o tom, že člověk by očkování nepřežil.
To ten muž, když se šel nechat očkovat, tak také v dobré víře.
Jak jsem o tom přemýšlel, tak mne taky napadla otázka, zda si náhodou nenechal ředitel třebas AstraZeneca nějak otestovat dopředu, zda vakcína je pro něho bezpečná, než si to do sebe nechal píchnout.
A pokud ano, proč ostatní lidé v populaci jsou očkování bez toho.
Chápu, že by to něco stálo a bylo by méně na bonusy manažerů.
Já bych se asi styděl mít bonus z produktu, co zabil lidi, protože některým byl dán bez dostatku opatrnosti.
Ale je vidět, že ne každý s tím má problém.
https://www.cnbc.com/2021/05/11/astrazeneca-investors-narrowly-approve-ceos-2021-pay-package.html
Dnes jsem také viděl, že se do těch firem, co vyvinuly vakcíny, napumpovaly stovky milionů dolarů z veřejných peněz, mají nejlepší zisky ty firmy za svou existenci a k tomu platí menší daně než většina jiných firem.
Většina vakcín se prodává předražená v bohatých zemích a do chudých jde jen pár procent vyrobených, protože tam nemohou mít vysoké marže.
Jestli si to pamatuji dobře, tak vakcíny se ve vyspělých zemích prodávají i za 30ti násobek výrobní ceny.
Byznys především.
Ten polyethylene glycol (PEG) by u mne vysvětlil, že já po očkováních měl x dní silné ekzémy a pak po týdny menší a sem tam ho mám od té doby vesměs z čehokoliv.
Což dříve nikdy nebylo.
S pozdravem,
JM 02.11.2021
Milá Wahlgrenis,
vyhadzujú nám tu sestričky, ktoré sa nechcú očkovať lebo ich do toho tlačia.
Zdroj
Ony vidia, koľko chorých ľudí po očkovaní tam chodí, a nechcú to riziko podstúpiť.
Len v Queenslende ich je 4000.
V Tazmánií stovky...
Už pred tým ich bolo málo a nestíhali.
Čo je toto za hnus?
Prečo?
Česima 02.11.2021





 24.10.2021
24.10.2021